ऑक्सीजन
ऑक्सीजन या प्राणवायु या जारक (Oxygen) रंगहीन, स्वादहीन तथा गंधरहित गैस है। इसकी खोज, प्राप्ति अथवा प्रारंभिक अध्ययन में जे. प्रीस्टले और सी. डब्ल्यू. शेले ने महत्वपूर्ण कार्य किया है। यह एक रासायनिक तत्त्व है। सन् १७७२ ई. में कार्ल शीले ने पोटैशियम नाइट्रेट को गर्म करके आक्सीजन गैस तैयार किया, लेकिन उनका यह कार्य सन् १७७७ ई. में प्रकाशित हुआ। सन् १७७४ ई. में जोसेफ प्रिस्टले ने मर्क्युरिक-आक्साइड को गर्म करके ऑक्सीजन गैस तैयार किया। एन्टोनी लैवोइजियर ने इस गैस के गुणों का वर्णन किया तथा इसका नाम आक्सीजन रखा, जिसका अर्थ है - 'अम्ल उत्पादक'।
उपस्थिति
ऑक्सीजन पृथ्वी के अनेक पदार्थों में रहता है जैसे पानी और वास्तव में अन्य तत्वों की तुलना में इसकी मात्रा सबसे अधिक है। ऑक्सीजन, वायुमंडल में स्वतंत्र रूप में मिलता है और आयतन के अनुसार उसका लगभग पाँचवाँ भाग है। यौगिक रूप में पानी, खनिज तथा चट्टानों का यह महत्वपूर्ण अंश है। वनस्पति तथा प्राणियों के प्राय: सब शारीरिक पदार्थों का ऑक्सीजन एक आवश्यक तत्व है।
निर्माण
कई प्रकार के आक्साइडों (जैसे पारा, चाँदी इत्यादि के) अथवा डाइआक्साइडों (लेड, मैंगनीज़, बेरियम के) तथा ऑक्सीजन वाले बहुत से लवणों (जैसे पोटैशियम नाइट्रेट, क्लोरेट, परमैंगनेट तथा डाइक्रोमेट) को गरम करने से ऑक्सीजन प्राप्त हो सकता है। जब कुछ पराक्साइड पानी के साथ प्रक्रिया करते हैं तब भी ऑक्सीजन उत्पन्न होता है। अत: सोडियम पराक्साइड तथा मैंगनीज़ डाइआक्साइड या चूने के क्लोराइड का चूर्णित मिश्रण (अथवा इसी प्रकार के अन्य मिश्रण भी) ऑक्सीजन उत्पादन के लिए प्रयुक्त होते हैं। हाइपोक्लोराइड अथवा हाइपोब्रोमाइट (जैसे चूर्ण विरंजन) के विघटन से या गंधक के अम्ल तथा मैंगनीज़ डाइआक्साइड या पोटैशियम परमैंगनेट की क्रिया से भी ऑक्सीजन मिलता है। गैसे की थोड़ी मात्रा तैयार करने के लिए हाइड्रोजन पराक्साइड अकेले अथवा उत्प्रेरक के साथ अधिक उपयुक्त है।
जब बेरियम आक्साइड को तप्त किया जाता है (लगभग 500 डिग्री सें. तक) तब वह हवा से ऑक्सीजन लेकर पराक्साइड बनाता है। अधिक तापक्रम (लगभग 800 डिग्री सें.) पर इसके विघटन से ऑक्सीजन प्राप्त होता है तथा पुन: उपयोग के लिए बेरियम आक्साइड बच रहता है। औद्योगिक उत्पादन के लिए ब्रिन विधि इसी क्रिया पर आधारित थी। ऑक्सीजन प्राप्त करने के विचार से कुछ अन्य आक्साइड भी (जैसे ताँबा, पारा आदि के आक्साइड) इसी प्रकार उपयोगी हैं। हवा से ऑक्सीजन अलग करने के लिए अब द्रव हवा का अत्यधिक उपयोग होता है, जिसके प्रभाजित आसवन से ऑक्सीजन प्राप्त किया जाता है, पानी के विद्युत्श्लेषण से जलजनके उत्पादन में ऑक्सीजन भी उपजात के रूप में मिलता है।
गुणधर्म
ऑक्सीजन का घनत्व 1.4290 ग्राम प्रति लीटर है (0 डिग्री सें., 750 मिलीमीटर दाब पर) और वायु की अपेक्षा यह गैस 1.10527 गुना भारी है। इसका विशिष्टताप (स्थिर दाब पर) 0.2178 कैलोरी प्रति ग्राम, 15 डिग्री सें. पर, है तथा स्थिर आयतन के विशिष्ट ताप से इसका अनुपात (15 डिग्री सें. पर) 1.401 है। ऑक्सीजन के द्रवीकरण में विशेषज्ञों को विशेष कठिनाई हुई थी, क्योंकि इसका क्रांतिक ताप-118.8 डिग्री सें., दाब 49.7 वायुमंडल तथा घनत्व 0.430 ग्राम/सेंटीमीटर 3 है। द्रव ऑक्सीजन हल्के नीले रंग का होता है। इसका क्वथनांक-183 डिग्री सें. तथा ठोस ऑक्सीजन का द्रवणांक-218.4 डिग्री सें. है। 15 डिग्री सें. पर संगलन तथा वाष्पायन उष्माएँ क्रमानुसार 3.30 तथा 50.9 कैलोरी प्रति ग्राम है।
ऑक्सीजन पानी में थोड़ा घुलनशील है, जो जलीय प्राणियों के श्वसन के लिए उपयोगी है। कुछ धातुएँ (जैसे पिघली हुई चाँदी) अथवा दूसरी वस्तुएँ (जैसे कोयला) ऑक्सीजन का शोषण बड़ी मात्रा में कर लेती हैं।
बहुत से तत्व ऑक्सीजन से सीधा संयोग करते हैं। इनमें कुछ (जैसे फॉस्फोरस, सोडियम इत्यादि) तो साधारण ताप पर ही धीरे-धीरे क्रिया करते हैं, परंतु अधिकतर, जैसे कार्बन, गंधक, लोहा, मैग्नीशियम इत्यादि, गरम करने पर। ऑक्सीजन से भरे बर्तन में ये वस्तुएँ दहकती हुई अवस्था में डालते ही जल उठती हैं और जलने से आक्साइड बनता है। ऑक्सीजन में हाइड्रोजन गैस जलती है तथा पानी बनता है। यह क्रिया इन दोनों के गैसीय मिश्रण में विद्युत् चिनगारी से अथवा उत्प्रेरक की उपस्थिति में भी होती है।
ऑक्सीजन बहुत से यौगिकों से भी क्रिया करता है। नाइट्रिक आक्साइड, फेरस तथा मैंगनस हाइड्राक्साइड का आक्सीकरण साधारण ताप पर ही होता है। हाइड्रोजन फास्फाइड, सिलिकन हाइड्राइड तथा जस्ता एथिल से तो क्रिया में इतना ताप उत्पन्न होता है कि संपूर्ण वस्तुएँ ही प्रज्वलित हो उठती हैं। लोहा, निकल इत्यादि महीन रूप में रहने पर और लेड सल्फाइड तथा कार्बन क्लोराइड सूर्य के प्रकाश में क्रिया करते हैं। इन क्रियाओं में पानी की उपस्थिति, चाहे यह सूक्ष्म मात्रा में ही क्यों न रहे, बहुत महत्वपूर्ण है।किसी भी धातु से ऑक्सीजन की क्रिया कराने पर धातु का दहन होता है।
उपयोग[संपादित करें]
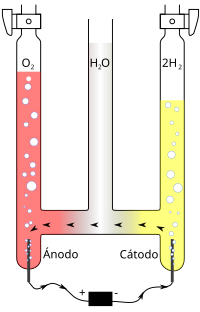
जीवित प्राणियों के लिए आक्सीजन अति आवश्यक है। इसे वे श्वसन द्वारा ग्रहण करते हैं। द्रव ऑक्सीजन तथा कार्बन, पेट्रोलियम, इत्यादि का मिश्रण अति विस्फोटक है। इसलिए इनका उपयोग कड़ी वस्तुओं (चट्टान इत्यादि) के तोड़ने में होता है। लोहे की मोटी चद्दर काटने अथवा मशीन के टूटे भागों को जोड़ने के लिए ऑक्सीजन तथा दहनशील गैस को ब्लो पाइप में जलाया जाता है। इस प्रकार उत्पन्न ज्वाला का ताप बहुत अधिक होता है। साधारण ऑक्सीजन के साथ हाइड्रोजन या एसिटिलीन जलाई जाती है। इसके लिए ये गैसें इस्पात के बेलनों में अति संपीडित अवस्था में बिकती हैं। ऑक्सीजन सिरका, वार्निशइत्यादि बनाने तथा असाध्य रोगियों के साँस लेने के लिए भी उपयोगी है। इसका उपयोग अधिकतर श्वसन व अनेक क्रियाविधियों मे होता है जिससे कार्बनडाइऑक्साइड निर्मुक्त होती है। कार्बनिक योगिकों के दहन से इसके साथ जल भी निर्मुक्त होता है। जैसे - C6H12O6+ 6O2→6CO2+6H2O CH4+2O2→CO2+2H2O
पहचान
दहकते हुए तिनके के प्रज्वलित होने से आक्सीजन की पहचान होती है (नाइट्रस आक्साइड से इसको भिन्नता नाइट्रिक आक्साइड के उपयोग से जानी जा सकती है)। ऑक्सीजन की मात्रा क्यूप्रस क्लोराइड, क्षारीय पायरोगैलोल के घोल, ताँबा अथवा इसी प्रकार की दूसरी उपयुक्त वस्तुओं द्वारा शोषित कराने से ज्ञात की जाती है।
ऑक्सीजन का चिकित्सा में उपयोग
ऑक्सीजन पूरक चिकित्सा में उपयोग किया जाता है। उपचार न केवल मरीज के रक्त में ऑक्सीजन के स्तर को बढ़ाता है, लेकिन कई तरह के रोगग्रस्त फेफड़ों में रक्त के प्रवाह के प्रतिरोध को कम करने का माध्यमिक प्रभाव होता है, हृदय पर काम का बोझ कम करना। ऑक्सीजन थेरेपी का उपयोग वातस्फीति, निमोनिया, कुछ हृदय विकारों (कंजेस्टेय ह्रदय विफलता), कुछ विकारों के कारण होता है जिससे फुफ्फुसीय धमनी के दबाव में वृद्धि हो जाती है, और किसी भी बीमारी से शरीर को गैसीय ऑक्सीजन लेने और उपयोग करने की क्षमता को कम करता है। उपचार अस्पतालों, मरीज के घर में या पोर्टेबल डिवाइसेज द्वारा तेजी से इस्तेमाल करने के लिए पर्याप्त लचीले होते हैं। ऑक्सीजन टेंट एक बार आमतौर पर ऑक्सीजन पूरक में उपयोग किया जाता था, लेकिन बाद में इसे ऑक्सीजन मास्क या नाक कैनुलास के उपयोग से ज्यादातर जगह ले लिया गया था।
ऑक्सीजन
![ऑक्सीजन]() Reviewed by rajyashikshasewa.blogspot.com
on
2:42 PM
Rating:
Reviewed by rajyashikshasewa.blogspot.com
on
2:42 PM
Rating:









No comments:
Post a Comment