गैसों के नियम
गैसों के व्यवहार से संबन्धित नियम अट्ठारहवीं शदी के अन्तिम काल में आये जब वैज्ञानिक धीरे-धीरे दाब, ताप और आयतन का सम्बन्ध समझने लगे। गैसों से सम्बन्धित कई नियम हैं किन्तु उनमें आदर्श गैस समीकरणऔर वान डर वाल्स समीकरण सबसे उपयोगी हैं। आजकल पुराने गैस नियम आदर्श गैस समीकरण के विशेष रूप जैसे समझे जाते हैं।
गैसों से सम्बन्धित नियम
- आदर्श गैस समीकरण
आदर्श गैस समीकरण, आदर्श गैस के आयतन, दाब एवं ताप के अन्तर्सम्बन्धों को व्यक्त करने वाला समीकरण है। इसे सर्वप्रथम सन १८३४ में बेन्वायट पॉल एमाइल क्लैपिरोन (Benoît Paul Émile Clapeyron) ने प्रकाशित किया था।
आदर्श गैस का समीकरण निम्नवत है:
जहाँ
- गैस का (निरपेक्ष) दाब है
- गैस का आयतन है
- गैस के मोलों की संख्या है
- सार्वत्रिक गैस नियतांक (universal gas constant) है,
- परम ताप (absolute temperature) है।
सार्वत्रिक गैस नियतांक, R, का मान मापन की विभिन्न इकाइयों में नीचे दिया गया है।
R = 8.315472 J·mol−1·K−1 = 8.314472 m3·Pa·K−1·mol−1 = 8.314472 kPa·L·mol−1·K−1 = 0.08205784 L·atm·K−1·mol−1 = 62.3637 L·mmHg·K−1·mol−1 = 10.7316 ft3·psi·°R−1·lb-mol−1 = 53.34 ft·lbf·°R−1·lbm−1 (for air)
2. बॉयल का नियम
बॉयल का नियम आदर्श गैस का दाब और आयतन में सम्बंध बताता है। इसके अनुसार, नियत ताप पर गैस का आयतन दाब के व्यूत्क्रमानुपाती होता है।
गणित में इसे निम्नलिखित रूप में अभिव्यक्त कर सकते हैं=-
या,
जहाँ P गैस का दाब है , V गैस का आयतन है, और k एक नियतांक है।
इसी को इस तरह से भी कह सकते हैं-
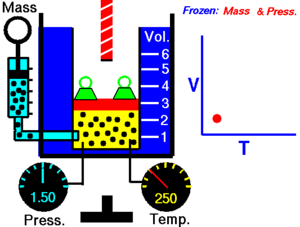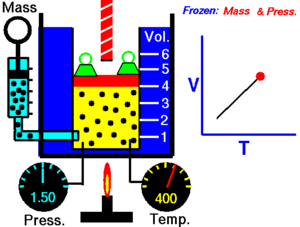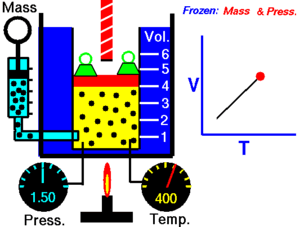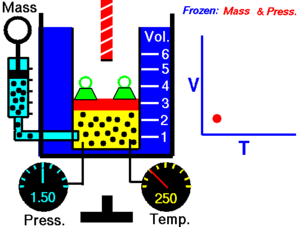
- 3. चार्ल्स का नियम
जब किसी शुष्क गैस को नियत दाब पर रखा जाता है तो केल्विन तापमान और आयतन एक दूसरे के अनुक्रमानुपाती होते हैं।चार्ल्स का नियम (इसे आयतन नियम के नाम से भी जाना जाता है) प्रायोगिक गैस नियम है जिसके अनुसार गैस को गर्म करने पर उसमें विस्तार होता है। चार्ल्स के नियम का आधुनिक कथन निम्नलिखित प्रकार से लिखा जा सकता है:
यह अनुक्रमानुपाती सम्बन्ध निम्न प्रकार लिखा जा सकता है:अथवाजहाँ:- V गैस का आयतन है
- T गैस का (कैल्विन पैमाने पर) तापमान है
- k नियतांक है।
- 4. अवोगाद्रो का नियम
- अवोगाद्रो का नियम गैस से सम्बन्धित एक नियम है जिसका नाम अमेदिओ अवोगाद्रो (Amedeo Avogadro) के नाम पर रखा गया है। इसे "अवोगाद्रो की परिकल्पना" (Avogadro's hypothesis) एवं "अवोगाद्रो का सिद्धान्त" के नाम से भी जाना जाता है। सन् १८११ में अवोगाद्रो ने यह परिकल्पना प्रस्तुत की, जो इस प्रकार है -
अवोगाद्रो का नियम [[File:
||H2O का उदाहरण-आवोगाद्रो का नियम]]
H2O का उदाहरण-आवोगाद्रो का नियम- समान ताप व दाब पर सभी आदर्श गैसों के समान आयतन में कणों या अणुओं की संख्या समान होती है।
(Equal volumes of ideal or perfect gases, at the same temperature and pressure, contain the same number of particles, or molecules.)
परिचयसन् 1811 ई. में इटली के रसायनज्ञ आवोगाड्रो ने अणु और परमाणु में भेद स्पष्ट करते हुए बताया कि परमाणु किसी तत्व का वह सूक्ष्मतम कण है जो रासायनिक क्रिया में भाग लेता है और इसका स्वतंत्र अस्तित्व हो भी सकता है और नहीं भी। अणु पदार्थ का वह छोटे से छोटा कण हे जिसमें पदार्थ के सारे गुण विद्यमान हों और उसका स्वतंत्र अस्तित्व संभव हो।आवोगाड्रो ने ही सर्वप्रथम कहा कि गैसों में केवल अणुओं का स्वतंत्र अस्तित्व संभव है न कि परमाणुओं का, इसीलिए गैस के आयतन को उसमें उपस्थित अणुओं से व्यक्त करना चाहिए। इस आधार पर आवोगाड्रो ने निम्नलिखित संबंध व्यक्त किया है :- एक ही ताप और दाब पर सभी गैसों के समान आयतन में अणुओं की संख्या समान होती है।
प्रारंभ में इस संबंध को आवोगाड्रो की परिकल्पना कहा गया था लेकिन बाद में जब प्रयोगों द्वारा इसका परीक्षण किया गया तो इसे आवोगाड्रो का सिद्धांत कहा जाने लगा। और अब इसे 'आवोगाड्रो का नियम' कहते हैं। परमाणु सिद्धांत के संशोधन में तथा गेलुसाक के नियम की व्याख्या करने में इस नियम का उयपयोग हुआ है। तात्विक गैसों की परमाणुकता निकालने में, अणु भार ज्ञात करने में, गैसों के भार आयतन के संबंध को ज्ञात करने में तथा गैसों के विश्लेषण में इस नियम का उपयोग किया जाता है।आवोगाड्रो की संख्या-किसी भी गैस के एक ग्राम अणु भार में अणुओं की संख्या समान होती है। इस संख्या को ही आवोगाड्रो की संख्या कहते हैं। विभिन्न विधियों से इसका मान 6.02x1023 निश्चित किया गया है। आवोगाड्रो की संख्या पांच विश्व स्थिरांको (युनिवर्सल कांस्टैंट) में से एक है। इसे रोमन अक्षर एन (N) से निरूपित करते हैं।उदाहरण
हाइड्रोजन एवं नाइट्रोजन के समान आयतन में अणुओं की संख्या समान होगी यदि वे एक ही ताप व दाब पर रखीं हो तथा आदर्श गैस के समान व्यवहार कर रही हों। व्यवहार में वास्तविक गैसों के लिये यह नियम पूर्णत: सत्य नहीं है बल्कि "लगभग सत्य" है।नियम का गणितीय रूप
- .
जहाँ:- V गैस का आयतन है,
- n गैस की मात्रा है,
- k एक नियतांक है।
अवोगाद्रो के नियम का सबसे महत्वपूर्ण निष्कर्ष यह है कि आदर्श गैस नियतांक (ideal gas constant) का मान सभी गैसों के लिये समान होता है। अर्थात्का मान सभी गैसों के लिये समान है, चाहे उनके अणों का आकार अथवा द्रव्यमान कुछ भी हो।यहाँ:- p गैस का दाब है,
- T गैस का ताप है।
किसी आदर्श गैस का एक मोल मानक ताप व दाब (standard temperature and pressure / STP) पर २२.४ लीटर स्थान घेरता है। इस आयतन को प्राय: आदर्श गैस का मोलर आयतन (molar volume) कहते हैं।
वास्तविक गैसें
- वान डर वाल्स समीकरण
- बर्थेलो का अवस्था समीकरण
अन्य
- डाल्टन का नियम
- हेनरी का नियम
- जूल-टॉमसन प्रभाव
- गैसों का अणुगति सिद्धान्त
- मैक्सवेल-बोल्ट्समैन वितरण
गैसों के नियम
 Reviewed by rajyashikshasewa.blogspot.com
on
3:40 PM
Rating:
Reviewed by rajyashikshasewa.blogspot.com
on
3:40 PM
Rating:
 Reviewed by rajyashikshasewa.blogspot.com
on
3:40 PM
Rating:
Reviewed by rajyashikshasewa.blogspot.com
on
3:40 PM
Rating:

























No comments:
Post a Comment